iNature
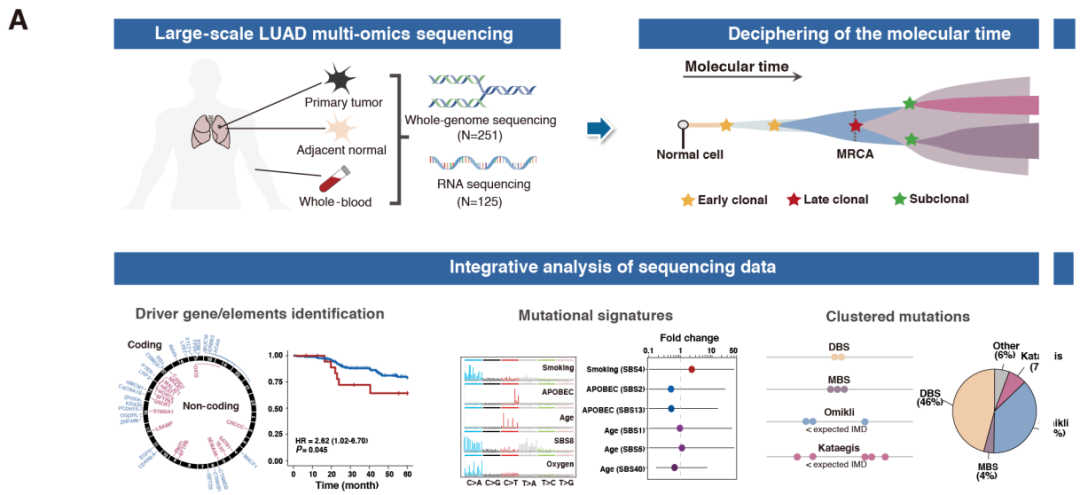
肺腺癌(LUAD)是一种具有显著基因组异质性的疾病,中国与欧洲血统个体间存在实质性基因组差异。解析驱动基因突变的时序特征可为阐明肿瘤进化规律提供依据,进而指导肺腺癌的诊断与治疗策略制定。2025年8月1日,南京医科大学沈洪兵,马红霞和四川大学李为民共同通讯在Cancer Research(IF=12.5)在线发表题为“Comprehensive Characterization of Somatic Mutation Timing Reveals the Evolutionary Trajectory of Lung Adenocarcinoma in Chinese Patients”的研究论文。该研究对251例中国血统肺腺癌患者的肿瘤样本进行全基因组测序,旨在重构体细胞变异(特别是非编码区突变)的进化轨迹。研究结果显示:烟草相关突变倾向于早期发生,并在每日28支香烟暴露量时达到平台期;经典驱动基因(如EGFR、TP53和RB1)突变同样呈现早期发生特征,且在吸烟者中表现出血统异质性。与外源性诱变因素不同,内源性诱变相关变异(如APOBEC)多发生于肿瘤进展晚期。3'非翻译区(3' UTR)是肺腺癌中最常发生改变的非编码元件,其中SFTPB和SFTPA1基因的3' UTR区域存在高频功能破坏性突变。与其他癌症类型相比,TERT启动子突变在肺腺癌中具有女性患者特异性。成簇突变(包括双碱基替换、多碱基替换及kataegis现象)显著影响肺腺癌进化进程,且在驱动基因中呈现过度富集特征。这些发现系统揭示了肺腺癌发生发展过程中基因组变异的动态演化规律。
肺腺癌(LUAD)是肺癌最常见的组织学亚型,也是全球癌症相关死亡的主要原因之一。虽然吸烟被公认为肺癌的主要危险因素(人群发病率与吸烟流行率的历史轨迹高度一致),但东亚地区存在一个引人注目的流行病学悖论:尽管东亚人群吸烟率较低,中国人群的肺腺癌发病率却显著高于欧洲人群,提示中国人群肺腺癌发病可能存在独特的致病机制。近期多项大规模测序研究揭示了中国与欧洲裔个体间存在复杂的基因组差异。表皮生长因子受体(EGFR)激活突变是中国肺腺癌最常见的驱动突变(检出率为40-60%),与欧洲患者7-10%的突变率形成鲜明对比。此外,KRAS和RB1基因突变以及ALK和RET基因融合也被确认为中国人群肺腺癌的驱动事件。然而现有研究主要聚焦于蛋白质编码基因的基因组变异,人类基因组中大部分非编码区域仍未被探索。尽管识别非编码驱动突变仍存在重大技术障碍,但越来越多的证据表明非编码调控元件的体细胞突变具有促瘤潜能。因此,有必要系统评估肺腺癌患者的非编码基因组变异。中国肺腺癌的体细胞基因组图谱(图片源自Cancer Research)肿瘤内异质性是肺腺癌的普遍特征,为肿瘤进化提供了物质基础并影响患者预后。虽然在肺腺癌体细胞驱动突变的鉴定方面已取得显著进展,但这些基因组病变在肿瘤进化过程中的时序动态仍不清楚。阐明肺腺癌发病机制并解析驱动突变的体细胞进化时序,可为理解肺癌发生机制和恶性维持提供重要依据,对肺腺癌的诊疗策略具有指导意义。该研究为系统解析编码区和非编码区的基因组驱动事件,对251例中国裔肺腺癌患者进行了全基因组测序(WGS)。作者的分析不仅验证了已知的肺腺癌驱动基因,还发现了多个具有潜在致癌意义的新候选位点(包括蛋白质编码基因座和非编码调控元件)。通过体细胞事件进展的时序重建,作者进一步观察到肿瘤进化不同时期的独特基因组模式。这些发现为深入理解全基因组水平的肺腺癌进化轨迹提供了重要线索,并为精准肿瘤学时代的肺腺癌临床管理奠定了基础。https://doi.org/10.1158/0008-5472.CAN-24-1799

 2025-08-05
2025-08-05
 6896
6896