Cell:十年磨一剑,刘光慧等团队解锁延缓灵长类衰老的祖细胞密码
 2025-06-18
2025-06-18
 6454
6454

随着年龄增长,人体干细胞储备逐渐耗竭,导致组织再生与稳态维持能力下降,这是机体衰老及衰老相关疾病的关键特征之一。然而,干细胞耗竭究竟是衰老的驱动因素还是伴随现象?外源性干细胞移植能否有效延缓衰老进程?这些问题一直是再生医学领域的核心科学命题。此外,人类干细胞在宿主衰老微环境(如持续的氧化应激、毒素和炎症)中植入效率低下、功能性驻留时间短暂,以及潜在的致瘤风险,共同构成了制约干细胞疗法应用于衰老干预的技术瓶颈。
2025 年 6 月 13 日,中国科学院动物研究所刘光慧课题组联合首都医科大学宣武医院王思课题组及中国科学院动物研究所曲静课题组,在 Cell 杂志发表题为「Senescence-resistant Human Mesenchymal Progenitor Cells Counter Aging in Primates」的研究论文,实现了灵长类抗衰细胞疗法的重大突破。
研究团队深入解析衰老调控机制,运用合成生物学方法对长寿基因通路进行重编程,成功构建了具有抗衰老、抗应激、抗恶性转化三重抗性的工程化人类抗衰型间充质祖细胞。这一成果不仅从概念上证明了通过基因线路遗传改造逆转人类细胞衰老时钟的可行性,还为工程化长寿细胞的产生奠定了理论基础。历经十余年的不懈探索,团队系统解码了细胞衰老调控通路,通过高容量腺病毒载体(HDAdV)介导的合成生物学重编程,构建了抗衰型人间充质祖细胞(SRC)技术体系。SRC1.0(2017)通过精准编辑抗氧化枢纽基因 NRF2,强化细胞内源性抗氧化防御网络;SRC2.0(2019)则对长寿节点基因 FOXO3 进行双位点工程化改造,赋予工程化祖细胞更强的抗衰和抗逆能力。
在系统评估 SRC 的综合抗衰效能方面,研究人员选用生理状态相当 60 - 70 岁健康人类的老年食蟹猴作为实验模型,开展了为期 44 周的 SRC 静脉输注干预研究。结果显示,SRC 不仅能显著延缓多器官衰老进程,还能重建机体稳态平衡。具体表现为:功能层面,提升老年灵长类动物的认知功能;组织层面,改善多组织退行性病变;细胞与分子层面,减少衰老细胞的异常积累,抑制炎性细胞浸润,增强基因组与表观基因组稳定性;基因表达层面,成功实现半数以上组织的衰老相关基因表达网络的系统性年轻化重构。机制探究表明,SRC 释放的外泌体在促进细胞年轻化、抑制慢性炎症以及维持基因组与表观基因组稳定性方面发挥了核心作用。
该研究突破了传统「单一疾病靶向治疗」的局限,采用合成生物学策略,实现了多器官协同抗衰,有力证明了「设计生命对抗衰老」的可行性。这一成果不仅为人类异体干细胞移植的临床转化奠定了基础,还开辟了可规模化生产的通用型细胞干预新路径,为应对衰老及相关疾病提供了新的解决方案。展望未来,随着研究的深入和技术的迭代,SRC 技术有望推动衰老干预从「被动应对」迈向「主动编程」的范式转变,为主动延长人类健康寿命开辟新路径。
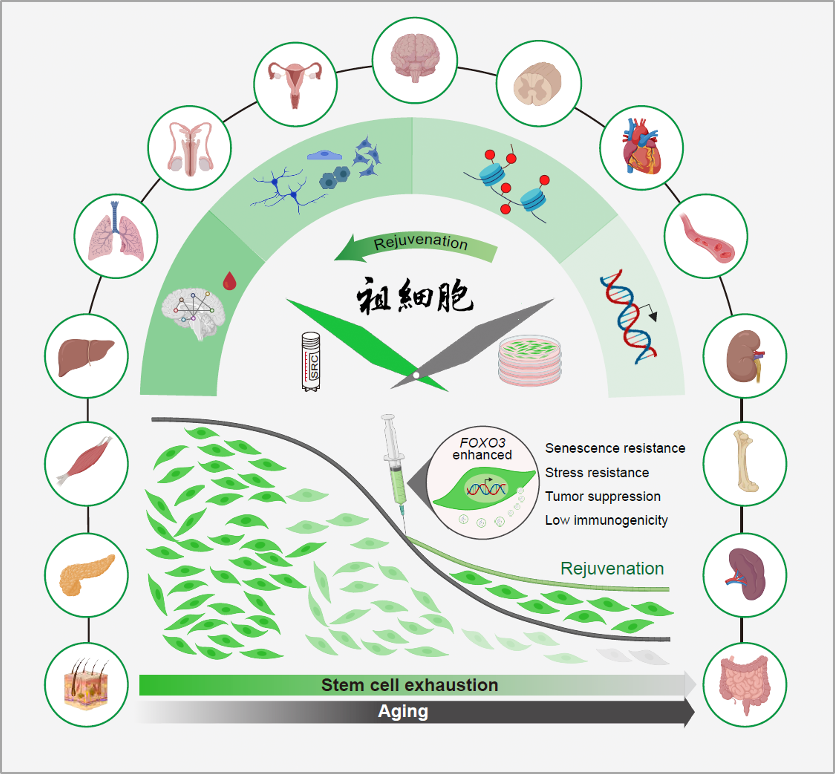
图 1. SRC 治疗延缓灵长类多器官衰老
中国科学院动物研究所刘光慧研究员、首都医科大学宣武医院王思研究员和中国科学院动物研究所曲静研究员为论文的共同通讯作者。
原文链接:

























