iNature
肝转移仍是结直肠癌(colorectal cancer, CRC)患者死亡的主要原因。然而,结直肠癌肝转移起始的分子机制尚未得到充分阐明。
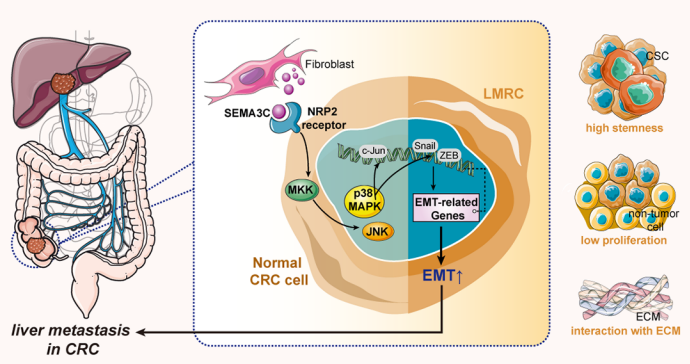
2025年5月22日,郑州大学刘灶渠和韩新巍共同通讯在PNAS(IF=9.4)在线发表题为“Cancer-associated fibroblast-derived SEMA3C facilitates colorectal cancer liver metastasis via NRP2-mediated MAPK activation”的研究论文。该研究发现存在一个在空间上定位于原发灶、在时间上分布于肝转移早期阶段的肿瘤细胞亚群,将其命名为肝转移起始细胞(liver metastasis-initiating cells, LMICs)。该细胞群具有高干性、低增殖、与周围基质成分发生活跃交互作用等特征,且与肝转移发生密切相关。值得注意的是,作者通过SEMA3C-NRP2受体-配体对发现癌症相关成纤维细胞(cancer-associated fibroblasts, CAFs)与LMICs之间存在显著的交互作用。体内外实验进一步证实,CAF分泌的SEMA3C可与NRP2受体结合,进而激活MAPK信号通路并促进结直肠癌肝转移。本研究为结直肠癌肝转移的早期防治提供了潜在治疗策略。
结直肠癌肝转移是导致结直肠癌(CRC)患者死亡的主要原因之一,其高死亡率与不良预后构成了重大全球疾病负担。肿瘤转移通常与原发灶中具有转移特性的癌细胞亚群及其与周围肿瘤微环境(TME)成分的复杂交互作用相关。这些具有干性和免疫逃逸特征的癌细胞最终脱离原发肿瘤,在适宜条件下作为"种子"定植于远端器官。因此,阐明这些细胞在生态位中的起源、特性及脆弱性,对于制定改善转移防治策略至关重要。单细胞RNA测序(scRNA-seq)技术的进展为转移演化研究提供了高分辨率手段。既往研究已鉴定出具有脑转移趋向性的肺癌细胞亚群,以及在腹膜播散中作为转移种子的卵巢癌转移起始细胞簇。然而,肿瘤亚群驱动结直肠癌肝转移的分子机制尚未完全阐明。近年来,癌症相关成纤维细胞(CAFs)日益受到关注。通过分泌蛋白酶和细胞外基质(ECM)成分等多种分子,CAFs构建了支持肿瘤细胞定植的转移生态位。值得注意的是,CAFs产生的基质金属蛋白酶(MMPs)作为关键蛋白水解酶,通过降解ECM成分形成允许性微环境,促进肿瘤细胞迁移侵袭。此外,CAFs分泌转化生长因子-β(TGF-β)等生长因子可诱导上皮-间质转化(EMT),赋予肿瘤细胞更强的迁移侵袭能力。CAFs与TME中其他细胞成分的交互作用还会形成免疫抑制环境或直接诱导肿瘤细胞EMT,最终促进转移进程。但CAFs调控早期转移播散的分子机制仍有待揭示。本研究鉴定出一类具有高干性、低增殖活性且与基质成分显著交互的肝转移起始细胞(LMICs)亚群。机制研究发现,CAFs分泌的SEMA3C与LMICs表面的NRP2受体结合,激活MAPK-p38/JNK信号通路驱动肝转移,该过程与不良临床结局相关。这些发现不仅阐明了结直肠癌肝转移的机制,更揭示SEMA3C-NRP2轴可作为阻断转移的潜在治疗靶点。
https://doi.org/10.1073/pnas.2423077122
 2025-05-27
2025-05-27
 5309
5309