iNature
膜脂质GDGTs(甘油二烷基甘油四醚)的环化增强是古菌适应各种环境压力的关键策略。然而,膜脂质环化的生理功能尚不清楚。
2025年5月12日,南方科技大学曾芝瑞和伊利诺伊大学Changyi Zhang共同通讯在PNAS(IF=9.4)在线发表题为“Cyclization of archaeal membrane lipids impacts membrane protein activity and archaellum formation”的研究论文。该研究报道,在嗜热嗜酸泉古菌Sulfolobusacidocaldarius中,GDGT环化酶突变体(缺乏GDGT环化能力)抑制了古菌鞭毛的形成,并降低了细胞的运动性。这种抑制作用是由古菌鞭毛操纵子的转录减少引起的,这可能是由于调控古菌鞭毛操纵子表达的转录因子ArnRs(跨膜蛋白)的C端结构域发生裂解。转录组和蛋白质组分析表明,GDGT环化缺陷广泛影响膜相关蛋白(包括呼吸链蛋白)的表达,并降低细胞ATP浓度。此外,系统发育分析表明,GDGT环化与古菌鞭毛形成之间的相关性在(超)嗜热古菌中普遍存在,这一点在广古菌Thermococcus kodakarensis中得到了进一步验证。作者的研究结果表明,古菌通过修饰其膜脂质来深刻改变细胞附属物和细胞生理,以适应环境波动。
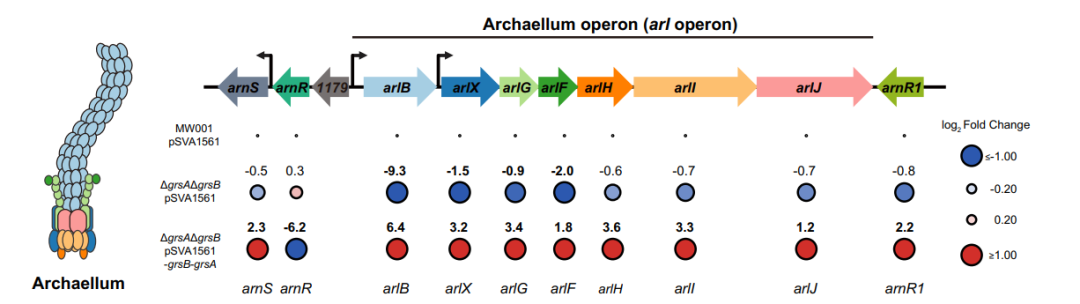
除了作为细胞内部和细胞外环境之间的屏障,细胞膜还包含三分之一的细胞总蛋白质,即膜蛋白质,是许多生理活动的重要场所。因此,细胞膜的物理结构和生物化学特性的改变可显著影响关键的细胞过程。与细菌和真核生物的磷脂双分子层膜不同,古菌独特的细胞膜由两类基于异戊二烯的醚键脂质构成:二烷基甘油二醚(古菌醇)和甘油二烷基甘油四醚(GDGTs)。古菌醇和GDGTs在膜中的组成在不同古菌类群中有所不同。虽然广域古菌中的盐古菌和一些产甲烷菌仅产生古菌醇,但泉古菌门和奇古菌门的许多成员主要利用GDGTs形成单层细胞膜,这被认为可以增强膜刚性、降低膜流动性并减少离子渗透性。这些特性为栖息于极端环境的古菌提供了适应性优势。近年来才阐明了古菌膜脂质GDGTs的生物合成与修饰机制。多项研究报告指出,属于自由基SAM蛋白超家族的酶高度参与古菌GDGTs的合成途径。在古菌中,GDGT分子最初是由四醚合酶(Tes)通过两个古菌醇分子的缩合而合成的。该分子可以通过环化、甲基化、羟基化、核心双植烷链的交联以及极性头基的取代而进一步修饰。大量研究表明,在许多古菌的脂质分布中,环状GDGTs是GDGTs的主要形式。GDGTs的环化是通过在核心双植烷链上引入1至8个环戊烷环和/或环己烷环来实现的。据报道,两种同源自由基SAM蛋白,GDGT环合酶A(GrsA)和GrsB,在此过程中共同发挥作用。具体而言,GrsA蛋白最初在无环GDGT(命名为GDGT-0)的C-7位置引入1至4个环戊烷环,生成GDGT-1至4。随后,在嗜热嗜酸古菌Sulfolobus acidocaldarius中,GrsB蛋白进一步在GDGT-4的C-3位置插入环戊烷环,生成GDGT-5至8。GDGT环化不足影响古菌操纵子基因的表达(图片源自PNAS)古菌中GDGTs的环化水平不仅受温度、pH和盐度等环境因素的影响,还受内部细胞过程的调控,包括能量通量、生长阶段和生长速率。先前,作者阐明了S. acidocaldarius协调两种GDGT环合酶时序表达的分子机制。GrsA蛋白在转录后水平受到调控,而GrsB则在转录和翻译水平受到调控,并且依赖于GrsA蛋白的产物。研究还发现,在S. acidocaldarius中,GDGT环化对于维持高温或低pH条件下的稳健细胞生长至关重要。然而,GDGT环化如何使古菌在极端环境中茁壮成长的分子机制仍知之甚少。在本研究中,作者证明在S. acidocaldarius中,GDGT环化减少会通过促进跨膜archaellum操纵子调节因子ArnR蛋白的裂解来抑制archaellum的形成和细胞运动性。此外,对Thermococcus kodakarensis grs突变体的实验也支持GDGT环化可调节archaellum的形成。进一步的转录组和膜蛋白质组分析表明,除了细胞运动性外,GDGTs的环化还可能广泛影响细胞膜上的各种细胞过程,包括能量产生与转换、细胞周期控制以及细胞内运输与分泌。
https://doi.org/10.1073/pnas.2423648122
 2025-05-26
2025-05-26
 5440
5440