iNature
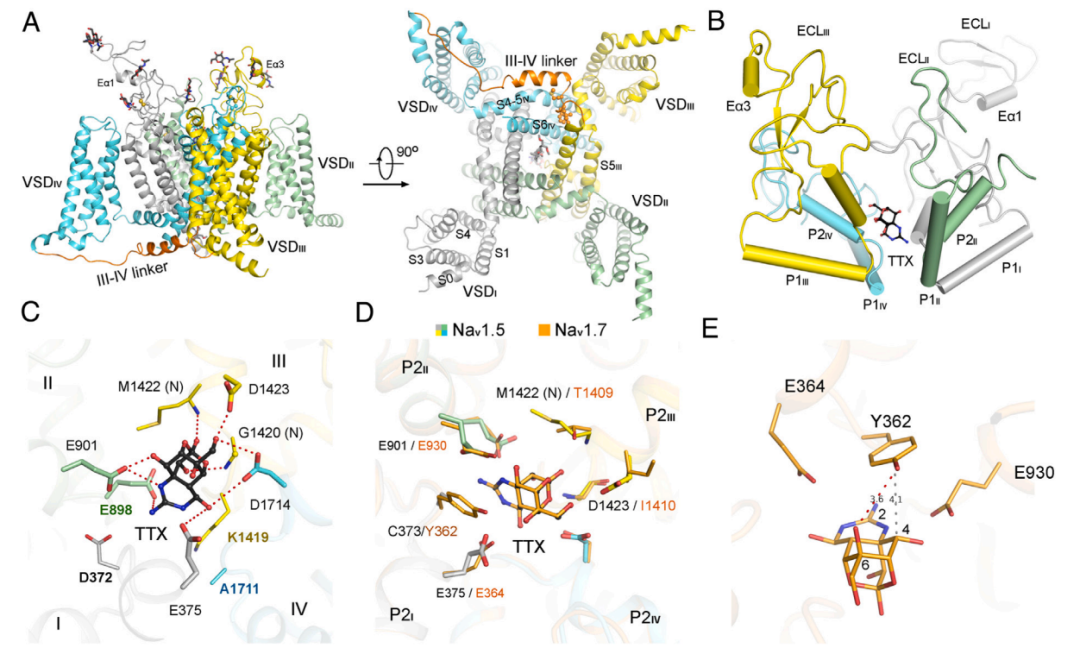
心脏电压门控钠通道Nav1.5对河豚毒素(TTX)具有抗性(TTXr)。2025年8月6日,清华大学刘志强和颜宁共同通讯在PNAS(IF=9.4)在线发表题为“Critical role of extracellular loops in differential modulations of TTX-sensitive and TTX-resistant Nav channels”的研究论文。该研究通过冷冻电镜技术(cryo-EM)解析了与β1辅助亚基共表达并经高浓度TTX处理的人源野生型Nav1.5通道的3.4 Å分辨率结构。结构比较揭示了TTXr与TTX敏感型(TTXs)Nav通道对TTX及β亚基产生差异性响应的分子决定因素。在TTXs Nav通道中,TTX的胍基与P2I螺旋上Tyr/Phe之间保守的阳离子-π相互作用,在TTXr亚型中因对应位点被Cys/Ser取代而消失,这解释了二者TTX敏感性的差异。β1亚基在电镜密度图中不可见。通过比较Nav1.5与TTXs型Nav1.7、TTXr型Nav1.8的差异,作者鉴定了四个位于胞外环(ECLs)的关键位点可能决定其β1结合能力的差异。当将TTXs型Nav1.7中对应位点替换为Nav1.5的残基时,β1对通道激活和失活的调节作用显著减弱。与此一致,该Nav1.7突变体的三维电镜重构中未观察到β1亚基。结合作者前期通过结构分析发现TTXr通道在ECLII上缺乏与β2/β4形成二硫键的关键Cys残基,这些功能-结构关系研究强调了胞外环在TTXs与TTXr Nav通道机制差异中的重要作用。该发现为开发亚型特异性药物提供了新的靶点探索方向。
 电压门控钠离子(Nav)通道在可兴奋性细胞和组织中对于动作电位的产生及电信号传导具有关键作用。作为典型的胍基孔道阻滞剂,河豚毒素(TTX)最初发现于河豚鱼体内,在过去半个世纪中被广泛用作Nav通道特性研究的分子探针。人类九种Nav通道根据对TTX的敏感性差异可分为TTX敏感型(TTXs)与TTX抵抗型(TTXr)。其中Nav1.1-1.4、Nav1.6和Nav1.7等TTXs亚型可被纳摩尔级浓度的TTX阻断;而Nav1.5、Nav1.8和Nav1.9仅在微摩尔级TTX作用下才会出现离子电导抑制,因此被定义为TTXr。这种敏感性差异源于二者较大的系统发育距离。相应地,两类Nav通道在生物物理特性上存在显著分歧:TTXr通道缺失一个在所有TTXs通道中高度保守的半胱氨酸残基,该残基可与β2或β4辅助亚基形成共价连接。此外,冷冻电镜(cryo-EM)结构显示,当与β1亚基共表达时,所有TTXs亚型均能形成稳定的通道复合体;相比之下,在TTXr通道Nav1.5和Nav1.8的三维电镜重构中从未观察到β1亚基对应的电子密度。既往研究推测Nav1.5特有的糖基化位点可能干扰β1结合,但该位点在其他Nav通道(包括另外两种TTXr亚型Nav1.8和Nav1.9)中均不存在。作者的结构分析进一步表明,这种柔性糖链难以对β1结合产生显著空间阻碍。为阐明TTXr与TTXs亚型差异的分子决定因素,作者选取人源Nav1.5和Nav1.7进行对比研究。由SCN5A基因编码的Nav1.5主要表达于心肌细胞,对心肌兴奋性具有重要调控作用。该通道的突变与多种严重心脏疾病相关,迄今已在致心律失常性疾病(如3型先天性长QT综合征(LQT3)、Brugada综合征(BrS)和婴儿猝死综合征)患者中发现超过400个Nav1.5错义突变,使其成为抗心律失常药物的重要靶点。I类抗心律失常药物(根据结合动力学和效应分为Ia、Ib和Ic亚类)通过阻断快速内向钠电流发挥作用。目前已解析的人源Nav1.5-奎尼丁(Ia类药物)复合物结构,以及截短型大鼠Nav1.5与氟卡尼或普罗帕酮(Ic类药物)的复合物结构,为I类抗心律失常药物的阻断机制提供了分子层面的解释。
电压门控钠离子(Nav)通道在可兴奋性细胞和组织中对于动作电位的产生及电信号传导具有关键作用。作为典型的胍基孔道阻滞剂,河豚毒素(TTX)最初发现于河豚鱼体内,在过去半个世纪中被广泛用作Nav通道特性研究的分子探针。人类九种Nav通道根据对TTX的敏感性差异可分为TTX敏感型(TTXs)与TTX抵抗型(TTXr)。其中Nav1.1-1.4、Nav1.6和Nav1.7等TTXs亚型可被纳摩尔级浓度的TTX阻断;而Nav1.5、Nav1.8和Nav1.9仅在微摩尔级TTX作用下才会出现离子电导抑制,因此被定义为TTXr。这种敏感性差异源于二者较大的系统发育距离。相应地,两类Nav通道在生物物理特性上存在显著分歧:TTXr通道缺失一个在所有TTXs通道中高度保守的半胱氨酸残基,该残基可与β2或β4辅助亚基形成共价连接。此外,冷冻电镜(cryo-EM)结构显示,当与β1亚基共表达时,所有TTXs亚型均能形成稳定的通道复合体;相比之下,在TTXr通道Nav1.5和Nav1.8的三维电镜重构中从未观察到β1亚基对应的电子密度。既往研究推测Nav1.5特有的糖基化位点可能干扰β1结合,但该位点在其他Nav通道(包括另外两种TTXr亚型Nav1.8和Nav1.9)中均不存在。作者的结构分析进一步表明,这种柔性糖链难以对β1结合产生显著空间阻碍。为阐明TTXr与TTXs亚型差异的分子决定因素,作者选取人源Nav1.5和Nav1.7进行对比研究。由SCN5A基因编码的Nav1.5主要表达于心肌细胞,对心肌兴奋性具有重要调控作用。该通道的突变与多种严重心脏疾病相关,迄今已在致心律失常性疾病(如3型先天性长QT综合征(LQT3)、Brugada综合征(BrS)和婴儿猝死综合征)患者中发现超过400个Nav1.5错义突变,使其成为抗心律失常药物的重要靶点。I类抗心律失常药物(根据结合动力学和效应分为Ia、Ib和Ic亚类)通过阻断快速内向钠电流发挥作用。目前已解析的人源Nav1.5-奎尼丁(Ia类药物)复合物结构,以及截短型大鼠Nav1.5与氟卡尼或普罗帕酮(Ic类药物)的复合物结构,为I类抗心律失常药物的阻断机制提供了分子层面的解释。与TTX结合的人Nav1.5全长的低温电镜结构(图片源自PNAS)
由SCN9A基因编码的Nav1.7主要分布于背根神经节神经元。过去二十年间,该通道成为疼痛治疗的重要靶点:其功能缺失与先天性痛觉缺失相关,而通道活性增强则见于红斑性肢痛症等多种疼痛性疾病。作者已解析了数十种Nav1.7与临床药物、试验化合物及毒素(包括TTX和另一种强效胍基神经毒素石房蛤毒素)复合物的高分辨率结构。本团队曾于2019年预印本中报道了TTX高浓度处理的全长人源Nav1.5冷冻电镜结构及Nav1.5-奎尼丁复合物结构。尽管奎尼丁结合Nav1.5的结构已公开发表,但β1结合差异的决定因素直至近期才被揭示。本文除阐明TTX敏感性的分子基础外,还发现胞外环(ECL)上四个位点对β1亚基免疫球蛋白(Ig)结构域的相互作用至关重要。电生理研究表明,将Nav1.7对应位点置换为Nav1.5的残基后,β1对通道激活和失活的调节作用几乎完全消失。值得注意的是,虽然采用与既往研究完全相同的共表达、纯化和成像方案,本研究中Nav1.7变体的冷冻电镜重构结果却未检测到β1亚基的存在。https://doi.org/10.1073/pnas.2510355122

 2025-08-11
2025-08-11
 5064
5064