牛津大学,Nature!
 2025-08-14
2025-08-14
 5894
5894


研究背景
小环碳环化合物的对映选择性构建对有机化学家来说是一个长期存在的挑战。亚烷基环丙烷 (ACPs)作为一类重要的此类化合物,因其在药物分子(和农用化学品中的常见结构特征而具有显著的商业重要性。
关键问题
然而,ACPs的合成主要存在以下问题:
1、ACPs的对应选择性合成方法非常有限
尽管ACPs具有广阔的应用前景,但对映选择性合成亚烷基环丙烷 (ACPs) 的方法非常有限,主要包括目联烯的不对称金属卡宾加成、还原的对映选择性亚烷基转移和手性转移等。
2、最常用的金属卡宾加成方法存在局限性
现有最常用的金属卡宾加成方法存在局限性,无法制备在每个环丙烷碳上都带有取代基的ACPs,这是由于加成发生在末端烯烃,受电子和空间因素双重影响。此外,尽管金属卡宾已被应用于贫电子烯烃,但这种化学方法尚未成功应用于联烯底物。
新思路
有鉴于此,牛津大学Darren J. Dixon、阿姆斯特丹自由大学Trevor A. Hamlin等人报道了通过使用双官能团亚氨基磷烷(BIMP)催化的,立体控制的,应变消除的早期解离,简便地合成高对映选择性的亚烷基环丙烷。通过对基础催化剂体系的小幅度修改,将反应范围拓宽至含有酯、酰胺、氧化膦和酮官能团的底物。通过设计合适的底物和重新调节催化剂的亚氨基磷烷部分,该转化被有效地应用于合成常见杀虫剂氯菊酯的单一立体异构体以及一系列环丙烷基杀虫剂核心。作者进行了最新的计算研究,以详细了解非对映选择性和对映选择性的机理途径和起源。
技术方案:
1、筛选了催化剂并对反应进行了优化
作者测试了多代BIMP催化剂的去共轭化能力。最终,C11在优化条件下实现了96%的产率和95% ee。
2、证实了转化方法的广泛适用性
研究证实了转化方法对多种底物适用。杂环化合物、烯丙基酯底物等均能高效转化,对映选择性高,酰胺类和磷氧化物底物也能高效转化,证明了转化的广泛实用性。
3、对映选择性合成了杀虫剂及其前体
作者开发了一种新策略,通过引入受保护的醇构建两个立体中心,成功优化C13催化剂,实现了拟除虫菊酯类杀虫剂核心结构的高效合成。
4、深入研究了反应机理及非对映选择性和对映选择性的起源
DFT研究揭示了选择性机理,催化转化通过应变释放策略为合成对映体富集的ACP和环丙烷提供了新途径,有望推动小环碳环转化研究。
技术优势:
1、开发了一种概念新颖、高效且广谱的催化对映选择性合成方法
本文开发了一种概念新颖、高效且广谱的催化对映选择性合成亚烷基环丙烷和环丙烷的方法。通过BIMP催化,利用应变释放去共轭化策略实现,并且对多种含有酯、酰胺、酮和氧化膦等官能团的底物表现出卓越的反应性和选择性。
2、实现了(1R,3R)-顺式-百菌烯菊酯单一立体异构体的全合成
本文实现了(1R,3R)-顺式-百菌烯菊酯单一立体异构体的全合成,以及多种环丙烷基杀虫剂核心的对映选择性合成。此外,结合DFT计算,深入阐明了反应的机制和立体选择性的起源,为未来催化剂设计和反应开发提供了理论指导。
技术细节
催化剂筛选与反应优化
作者对BIMP催化剂的去共轭化能力进行了测试。第一代催化剂(C1-C5)对底物3a表现出良好至优秀的产物收率(68%-98%),但对映选择性与碱强度密切相关,而碱性更强的C3催化剂则无对映选择性(0% ee)。硫脲催化剂C2和脲基催化剂C4、C5虽氢键供体强度不同,但均展现出良好对映控制,且脲基催化剂平均产率更高。第二代催化剂(C6-C11)引入额外α-氨基酰胺部分以提高对映选择性,C6对映选择性较低(-11% ee),但引入第二个立体中心(C7)后ee值提升至42%,进一步增加近端立体中心R2的空间体积可将ee提高至81%。最终,通过降低C11的Brønsted碱性并改用Et₂O溶剂,成功以96%产率和95% ee获得产物3b。对于α,β-不饱和酮底物4a,C12催化剂在室温下无对映选择性(0% ee),但通过缩短反应时间(0.5分钟)或降低温度至-78°C,产物4b能以99%产率、>20:1 d.r.和93% ee高效形成。
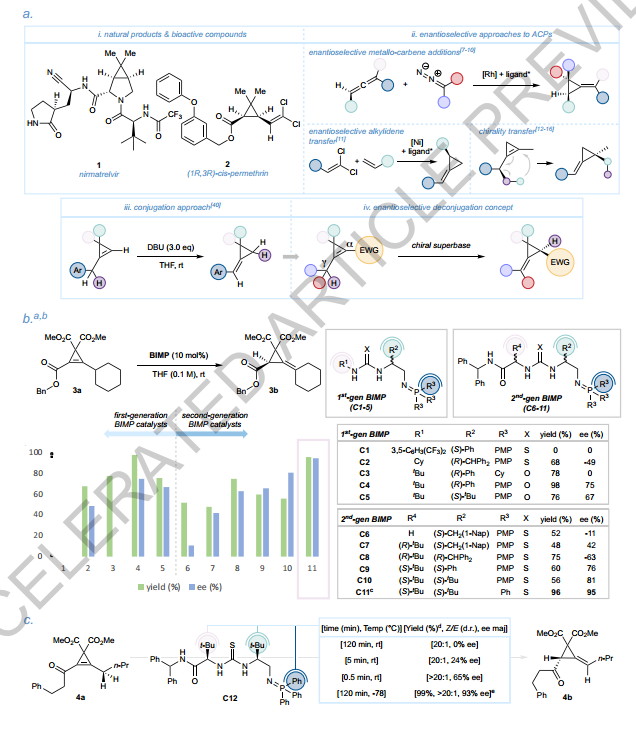
图 现有技术、概念和反应优化
反应底物范围的拓展
该转化方法在优化条件下对多种底物表现出广泛的适用性。酯、酰胺、氧化膦类底物使用C11催化剂,酮类底物使用C12催化剂。环己基被环戊基取代后,产物5b以94% ee和96%产率在5小时内获得。杂环化合物(6b、7b)耐受良好,对映选择性分别为95% ee和96% ee。含有烯丙基酯的底物8a高效转化,对映选择性达97% ee。含有正丙基链和苄基酯的底物9a在30分钟内转化为9b,具有>20:1的Z选择性、95% ee和97%产率。多种官能化的烷基链(如烷基氯、OTBS、苯基)也能高效转化,对映选择性通常超过90%。含有悬垂酮基团的底物23a顺利转化为烯酮23b,实现了>20:1 d.r.和98% ee的近乎完美对映选择性。此外,酰胺类底物(25a-29a)和磷氧化物底物30a也能高效转化,产物30b以95%产率和99% ee获得,证明了该转化的广泛实用性。
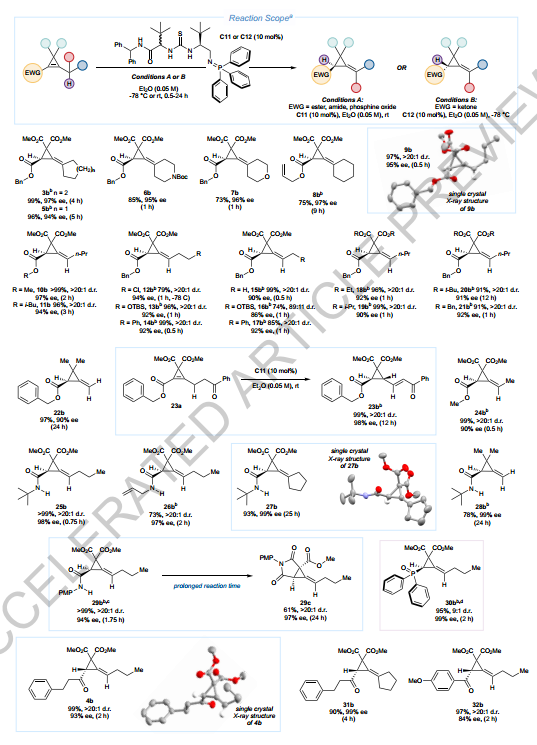
图 环丙烯类化合物的不对称选择性应变缓解解偶联反应的反应范围
杀虫剂及其前体的对映选择性合成
作者针对拟除虫菊酯类杀虫剂的重要结构特征,开发了一种新策略:通过在去质子化位点引入受保护的醇,双键迁移后形成烯醇醚,脱保护生成醛,从而一步构建两个立体中心。初始催化剂C11对底物33a无效,但优化后的C13催化剂成功实现了目标产物33b的高效合成,产率达90%,具有>20:1的非对映选择性和98% ee。利用C13,作者实现了(1R,3R)-顺式-百菌烯菊酯的对映选择性合成,六步内完成,ee值为98%。此外,C13还适用于合成其他拟除虫菊酯类杀虫剂的醛核心前体,如kappa-tefluthrin(35b)、dimefluthrin(36b)和kappa-bifenthrin(37b),这些产物均在1小时内以>97% ee的单一非对映异构体形式获得。C13还可应用于不含悬垂醚链的底物,例如螺环环丙烯38a,其去共轭产物38b在2小时内快速形成,具有>20:1 d.r.和99% ee。此外,ACP产物还可进一步衍生化,如将39b转化为醇40,以及将22b通过立体选择性环氧化转化为螺环41,均保持了高对映富集度。
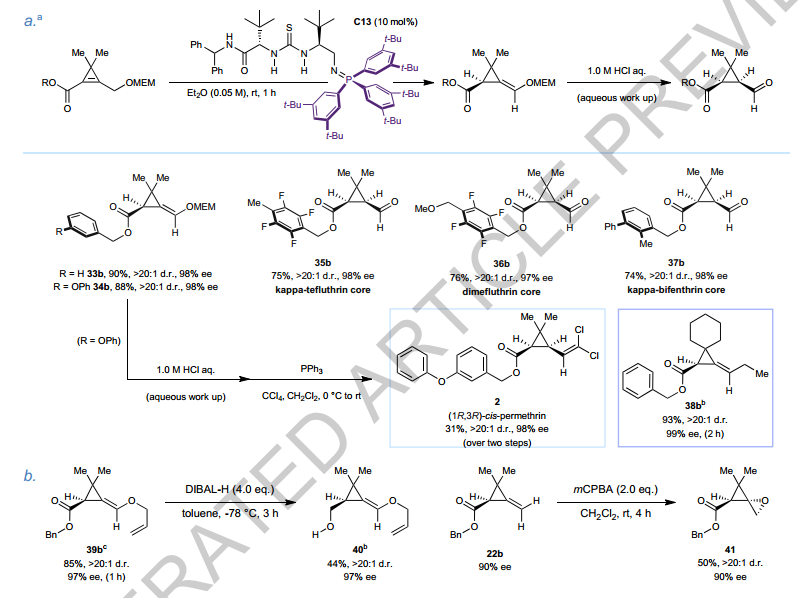
图 杀虫剂及其前体的不对称合成
DFT计算研究
作者通过DFT计算深入研究了反应机理及非对映选择性和对映选择性的起源。计算表明,反应可能通过两步催化序列进行:首先是γ-去质子化,随后是对映选择性α-再质子化。以酯取代的环丙烯24a为例,催化剂C11与24a形成氢键结合的中间体Int1,最低过渡态TS1-Z导致二烯醇中间体Int2的非对映选择性形成。再质子化通过TS2-R或TS2-S进行,能量最低的TS2-R形成(R)-产物P-1,与实验结果相符。TS2-R的几何构型得益于24a在催化剂结合口袋中的契合,其中S(硫脲)-H(酰胺)氢键固定了催化剂“左臂”的构象自由度,形成三维定义的口袋,减少空间排斥。此外,计算揭示了多重分子内和分子间稳定相互作用网络,包括氢键和CH-π相互作用。对于酮取代底物,计算也揭示了与实验一致的优选路径。酯类和酮类环丙烯的决速步骤不同,可能归因于其二烯醇中间体的稳定性和反应性差异。
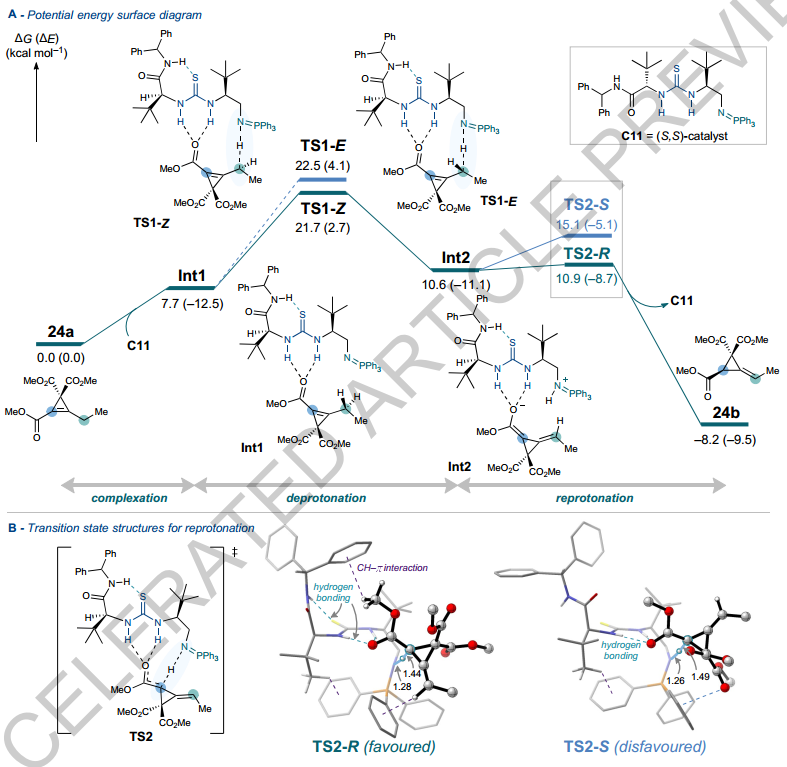
图 酯基取代环丙烯反应途径的密度泛函研究
展望
总之,本研究开发了一种高效、新颖、适用范围广的手性ACPs和环丙烷合成方法。两种BIMP催化剂对多种底物表现出优异的活性和选择性,通过底物设计和催化剂调整,实现了(1R,3R)-顺式二氯苯醚菊酯的全合成,为杀虫剂核心合成提供了新路线。DFT研究揭示了选择性机理,催化转化通过应变释放策略为合成对映体富集的ACP和环丙烷提供了新途径,有望推动小环碳环转化研究。
参考文献:
Golec, J.C., Tan, DH., Yamazaki, K. et al. Catalytic enantioselective synthesis of alkylidenecyclopropanes. Nature (2025).
https://doi.org/10.1038/s41586-025-09485-y

























