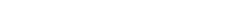万能生物催化剂全长晶体结构获破解
 2020-06-01
2020-06-01
 1768
1768

完整酶结构 郭瑞庭供图

电子传递机制 郭瑞庭供图
《自然—通讯》在线发表了首个细胞色素P450酶的全长精细三维结构,解答了这一数十年未解的科学难题。
湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室教授陈纯琪、马立新和郭瑞庭合作完成了这项工作。他们解析了一种P450酶CYP116B46的晶体结构,并阐明电子在分子内传递的方式。这对了解P450的结构及完整机理提供了重要指导,且对P450酶在医药和工业领域的应用具有重要价值。
万能生物催化剂
细胞色素P450是一种酶蛋白,最早于1955年在老鼠的肝脏细胞中发现,因为其与一氧化碳结合的还原态吸收光谱波长约在450 nm而得名。
该蛋白由血红素(heme)结构域和含有黄素单核苷酸(FMN)的还原酶结构域组成;这两个部分通过包含铁硫簇的铁氧还蛋白域相连。“细胞色素P450是一个庞大的酶家族,简称为CYP,参与许多天然产物的合成途径与毒物、药物代谢反应。”论文通讯作者陈纯琪告诉《中国科学报》,在植物中,P450家族参与一些特殊化合物的合成,如青蒿素和紫杉醇;在人体中,P450家族主要参与解毒过程,如化解可以导致癌症的黄曲霉毒素等。
这是因为P450的催化多能性很高,涉及20余类反应,包括羟化反应、环氧化反应和成环反应等。其底物谱极广,可以识别芳香族、聚酮类、萜类、肽类、糖类等类型的底物,拥有“万能生物催化剂”之称。
它还具有高度区域选择性和立体选择性,能特异性的识别结构位点和方向。此外,P450酶的底物结合区具有高度可塑性,透过酶工程改造可以改变底物谱,在重要化学品和药物制造方面的应用深具潜力。
因此,药物活性化与代谢主要都是由CYP这个酶家族所负责的,大约囊括了生物体中此类代谢的75%。
P450系统广泛存在于所有生物甚至病毒中,已发现超过18000种P450系统。人体内已经发现超过57种P450系统,大部分是膜蛋白,主要分布在粒线体内膜或内质网上。不过,在大肠杆菌中未发现此类酶蛋白的踪影。
“绝大多数P450酶需要氧化还原酶来提供电子,以活化底物结合区的血红素,进而转化底物。”陈纯琪说,建立一个P450系统必须寻找同源或者相匹配的氧化还原酶。
在P450系统的9个家族中,只有2个家族在同一条多肽链上自带氧化还原酶,被称为自给自足的P450酶,这类酶主要来自细菌。另外一些P450系统则需要从外界获得匹配的氧化还原酶,这种情况主要发生在动物体内。
“自给自足的P450酶在生物技术应用方面是极具吸引力的生物催化剂。因此,自给自足P450酶内部电子如何传递是一个非常有趣且重要的课题。”论文通讯作者郭瑞庭告诉《中国科学报》,此前,科学家已经对P450系统中的血红素和FMN等结构域研究比较清楚,但对中间连接部分始终不了解,缺乏全长精细结构。
“在蛋白纯化及培养晶体的过程中,P450酶极易从中间断裂或降解,因而很难获得完整的全长三维立体结构。”陈纯琪说。
获得全长P450精细三维结构
目前已知的自给自足P450酶有两类。第一类以来源于巨大芽孢杆菌的CYP102A1为代表,由氮端的血红素结构域和碳端的P450还原酶 (CPR)组成,电子传递的方向是从碳端向氮端传递。虽然这类P450酶的全长精细结构仍然缺失,但对于这类P450酶的电子传递机理也有了一些粗略的理论。

第一类自给自足P450酶结构域排列 郭瑞庭供图
第二类是CYP116,该研究所涉及的CYP116B46就属于这一类。这类P450由氮端的 heme结构域和碳端的邻苯二甲酸二加氧酶还原酶类结构域(PDR)组成,PDR包含了FMN-依赖的还原酶结构域与铁氧还蛋白结构域。

第二类自给自足P450酶结构域排列 郭瑞庭供图
自给自足P450酶的一条多肽链内是如何将电子从碳端传递到氮端的血红素的?由于30多年来长期缺乏全长的蛋白质结构信息,在该项研究之前尚不清楚。
英国曼彻斯特大学化学生物学教授萨宾·L·弗利奇(Sabine L. Flitsch)说:“获得全长酶是一项了不起的成就。”许多小组,包括她自己的小组,都试图解析这些结构,因为它们作为生物催化剂具有重大的应用潜力。
“可以说晶体制备已经超越科学,几乎成为一门艺术。”陈纯琪说,要想获得一个完整的大蛋白晶体结构,其难度可想而知。
该研究所用的CYP116B46相对稳定,加上郭瑞庭长年从事晶体制备和结构解析工作积累的丰富经验,他们得以利用X射线晶体学对其完整的晶体结构进行解析。
结构分析表明,在这种酶中,FMN足够接近铁硫簇以实现直接电子转移;但血红素离铁硫簇太远,不允许电子直接转移,而是依靠5个“二传手”氨基酸实现传递。
“我们解析了来源于CYP116B46全长的晶体结构,且建立了清晰的酶结构模型。”郭瑞庭说,这条连续性的多肽折叠成三个结构域,由两段连接肽相连,从氮端到碳端依序为:血红素结合域、还原酶结构域和铁氧还蛋白结构域。
郭瑞庭介绍,结构解析后发现,CYP116B46三个结构域的排列与电子传递的方向竟然非常一致。血红素结合域的底物结合区朝向外,有利于底物进入结合,这显示结构的排列相当合理。其中,还原酶结构域和铁氧还蛋白结构域的直线距离为7.9Å,有利于电子的直接传递。
“科学家普遍认为,小于8 Å的距离是电子可以直接传递过去的。”郭瑞庭说。
另一方面,铁氧还蛋白结构域和血红素的直线距离达25.3 Å,超过目前认定的有效直接电子传递距离。
5个“二传手”传递电子
“在这两个氧化还原中心之间,由其他辅助因子来帮助电子传送的可能性较低。”郭瑞庭解释说,因为结构显示二者之间的通道狭窄,缺乏其他辅助因子结合的特征。另一方面,考虑到氨基酸也是一种电子载体,所以二者之间的氨基酸也有可能在电子传送的过程中扮演重要角色。
“现在我们有机会设计还原酶结构域和电子转移途径。”陈纯琪说。
为了分析这些氨基酸的侧链基团对于CYP116B46酶活性的影响,他们将这些位点分别突变成丙氨酸,并进行产物生成量的测定来评估每个氨基酸扮演的角色。
郭瑞庭介绍,酶活测试结果显示,R388、R718、E723、S726和E729的丙氨酸突变体活性明显下降。将这些位点再次标定在结构上,可以看出大致的电子传递方向。
R378A突变体蛋白质缺乏血红素造成的红色,一氧化碳处理后也没有出现吸收峰带移的现象。加上R378的所在位置邻近血红素,推测R378可能与结合血红素相关。因此,R378A的突变造成的效应更加复杂,需要进一步实验才能判断此一位点对于CYP116B46电子传递的影响。

[2Fe-2S] 与heme通道的氨基酸突变验证 郭瑞庭供图
“知道了氨基酸在电子传递过程中扮演的角色之后,我们就可以考虑寻找替换别的有效氨基酸,提高电子传递效率。”郭瑞庭解释说,这就好像换上一个手更长的“二传手”,让电子能更快的传递过去。
这种设计将提高催化反应的效率。P450全长结构的解析,对于了解自给自足P450酶催化机理是一个非常重要的里程碑,对于P450酶改造与应用更具有重要的指导意义。
相关论文信息:https://doi.otg/10.1038/s41467-020-16500-5
版权所有:本文来源科学网,版权归作者所有
文章转摘只为学术传播,如涉及侵权问题,请联系我们,我们将及时修改或删除